Welcome
to Our Site
Welcome visitors to your site with a short, engaging introduction. Double click to edit and add your own text.

Químicos Curie



Valoraciones ácido-base
La valoración ácido-base, también llamada titulación ácido-base, es una técnica analítica cuantitativa que se utiliza para determinar la concentración desconocida de una solución ácida o básica, utilizando una solución de concentración conocida (el valorante). El proceso implica la adición gradual del valorante a la solución de concentración desconocida hasta que se alcanza el punto de equivalencia, donde la cantidad de ácido y base son químicamente equivalentes. Este punto se detecta utilizando un indicador de pH que cambia de color, o un medidor de pH.
Material básico empleado para una valoración ácido-base
Bureta
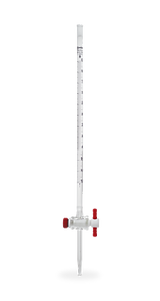
Mesa o soporte de fondo blanco - se emplea para apreciar el cambio de color de la disolución.
Vaso precipitados

Pipeta indicador de pH o Indicador ácido-base (se emplean muchos diferentes, según la reacción)

Matraz Erlenmeyer (matraz cónico)+Disolución estándar (una disolución de concentración conocida, como la de Na2CO3 en agua)Disolución o muestra cuya concentración queremos conocer.


En una valoración ácido-base a veces es frecuente el uso de un indicador ácido-base que sufra un cambio de color en las inmediaciones del punto final. También se puede emplear un pH-metro con esta misma finalidad, en cuyo caso se registra la variación del pH a medida transcurre transcurre la transferencia de hidrogeniones, H+, entre el ácido y la base. Para ello se emplean electrodos específicos conectados a un potenciómetro. Cerca del punto de equivalencia o punto final de la valoración se observa un cambio muy brusco de dicho potencial.
En otros casos, si el reactivo valorante o la sustancia valorada experimentan un cambio de color puede utilizarse esta característica para establecer el punto final de la valoración.
Clases de valoración ácido-base


Se pueden clasificar en dos grandes grupos:
Acidimetrías:
Determinación de la concentración de una base empleando un ácido fuerte de concentración conocida como sustancia valorante. Se emplea casi siempre ácido clorhídrico, HCl; a veces ácido sulfúrico, H2SO4 (Las disoluciones de ácido perclórico y de ácido sulfúrico también son estables y son útiles para las titulaciones donde el ion cloruro interfiere formando precipitados); y casi nunca los ácidos nítrico (HNO3) y perclórico, (HClO4).
Alcalimetrías.
Determinación de la concentración de un ácido empleando una base fuerte de concentración conocida como sustancia valorante, como el NaOH.
La reacción completa de un ácido con una base en disolución acuosa, denominada genérica-mente reacción de neutralización, da lugar a la formación de una sal y, por lo general, de agua.Por ejemplo:

📲 Escanea el código y ¡practica ahora!
