
TEORÍA ARRHENIUS
A finales del siglo XIX, S. Arrhenius estudió la disociación iónica de los compuestos inorgánicos, que se producía al disolverlos en agua. Comprobó que había compuestos que en disolución conducían la corriente eléctrica; la razón debía ser que daban lugar a iones. Para ello, se han de romper enlaces covalentes polares y formarse iones. Esto les sucede a los ácidos y a algunas bases: se disocian originando iones. Además, hay bases como los hidróxidos que ya tienen iones en su constitución en estado puro, y esos iones son los mismos que hay cuando el hidróxido se disuelve. S. Arrhenius llegó a la conclusión de que las propiedades características de las disoluciones acuosas de los ácidos se debían a los iones hidrógeno, H+, mientras que las propiedades típicas de las bases se debían a los iones hidróxido, OH-, (también llamados hidroxilo u oxhidrilo).

Svante Arrhenius
1884
Svante August Arrhenius nació el 19 de febrero de 1859 en la ciudad de Vik, en Suecia
Fue un científico y profesor sueco galardonado con el Premio Nobel de Química de 1903 por su contribución al desarrollo de la química con sus experimentos en el campo de la disociación electrolítica.
En su teoría, Arrhenius formuló las siguientes definiciones para los ácidos y las bases:
Ácido :es una sustancia que en disolución acuosa se disocia produciendo iones hidrógeno, ( protones ), H+.
Base :es una sustancia que en disolución acuosa se disocia produciendo iones hidroxilo ( u oxidrilo ), OH.


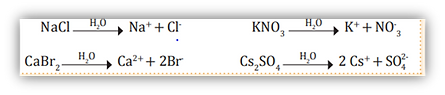
Esta disociación iónica, o disociación electrolítica, justifica laconductividad eléctrica de las disoluciones acuosas de muchas sustancias denominadas electrolitos


La reacción de neutralización tiene lugar cuando un ácido reacciona completamente con una base y se produce una sal y agua:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)H2SO4 (aq) + 2 KOH (aq) → K2SO4 (aq) + 2 H2O (l)
HA (aq) + BOH (aq) → BA (aq) + H2O (l)
En general:
En realidad, el ácido, la base y la sal están disociados en ladisolución acuosa, por lo que podemos escribir esta reacción eliminando de ella los llamados iones espectadores.
H+ (aq) + A- (aq) + B+ (aq) + OH- (aq) → B+ (aq) + A- (aq) +H2O (l)
H+ (aq) + OH- (aq) → H2O (l)
De donde deducimos:


Reacción de neutralización
Neutralización entre vinagre y jabón
Consiste en la combinacióndel ion H+, procedente del ácido, con el ion OH-, procedentede la base, para producir H2O no disociada.

¿Qué pasa cuando mezclamos vinagre con jabón?
El ácido acético (del vinagre) libera H⁺.El jabón (o sus restos de base) liberan OH⁻.Entonces, ocurre una reacción de neutralización, donde los iones H⁺ y OH⁻ se combinan para formar agua (H₂O):H⁺ + OH⁻ → H₂OAdemás, se forma una sal, que en este caso es el acetato de sodio.
Ejemplo

La reacción de neutralización, según la teoría de Arrhenius, ocurre cuando un ácido y una base se combinan en solución acuosa. El ácido libera iones hidrógeno (H⁺) y la base libera iones hidroxilo (OH⁻). Estos dos iones se unen para formar una molécula de agua (H₂O), que se considera "no disociada" porque ya no se separa nuevamente en H⁺ y OH⁻. Esta reacción elimina las propiedades ácidas y básicas de las sustancias, por eso se llama neutralización, ya que el resultado es una sustancia neutra: el agua.

