Welcome
to Our Site
Químicos Curie




Concepto de pH
¿Qué es el pH?
El término "pH" es una abreviatura de "potencial de hidrógeno". El pH es una unidad de medida que representa la concentración de iones de hidrógeno en una solución.
Esta unidad fue introducida por el bioquímico Søren Peter Lauritz Sørensen en 1909. Era una forma sencilla de representar la concentración de iones de hidrógeno en una solución durante las titulaciones. Cuando se añade un ácido o una base al agua, ese compuesto se disocia en iones. En el caso de los ácidos, uno de esos iones es un ion hidrógeno (H + ) y en el caso de las bases, uno de los iones es un ion hidróxido (OH – ). Esta descripción de ácidos y bases se conoce como la teoría de Arrhenius. La concentración de iones de hidrógeno se describe a menudo mediante la escala de pH como un valor numérico.
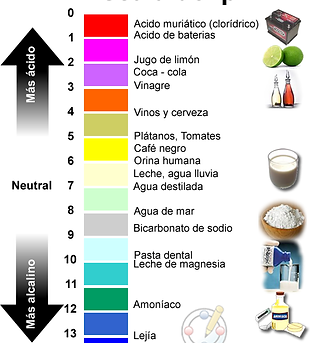
La escala de pH: ácido, neutro y básico
La escala de pH describe la acidez de una solución: ácida, neutra o básica. Una solución con un pH inferior a 7 es un ácido, exactamente 7 es una solución neutra y superior a 7 es una base.
Las bases tienen menos iones de hidrógeno pero más iones de hidróxido, representados por el pOH o «potencial de iones de hidróxido».


¿Cómo se mide el pH?
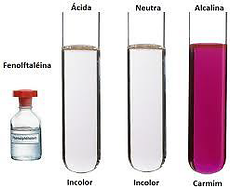
Usando indicadores ácido-base.
Los indicadores son compuestos que cambian de color al cambiar el pH de la disolución en que se encuentren. Por ejemplo, la fenolftaleína es un líquido que toma color rosa si es añadido a una base y se torna incoloro si es añadido a un ácido.
Otro ejemplo es el papel tornasol: si se sumerge un fragmento en una disolución ácida se torna rojo-anaranjado, y si se sumerge en una solución básica se oscurece tomando color azul. También existen algunos tipos de papel tornasol con escalas de colores más específicas que indican valores de pH más exactos. Usando un potenciómetro o pH-metro. Es un equipo electrónico que nos da directamente el valor de pH de una solución. La medición del pH utilizando este equipo es más exacta que usando papel tornasol.
Ejercicio práctico



una disolución acuosa es
Por definición, el pH de

El pH de una disolución es el logaritmo negativo de la expresión numérica de la concentra-ción molar del ion H3O+.Obtenemos la escala de pH, que varía desde 0 a 14. Como se ve a continuación, el valor delpH disminuye a medida que aumenta la acidez de la disolución, y viceversa.

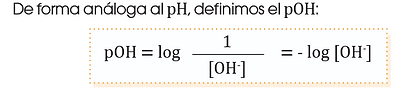
Concepto de pOH
El pOH es una medida que permite conocer el grado de alcalinidad o basicidad de una solución acuosa. Esta medida se basa en la concentración de iones hidroxilo (OH⁻) presentes en la sustancia. Así como el pH se enfoca en la acidez a través de los iones hidrógeno (H⁺), el pOH se centra en la cantidad de iones hidroxilo, que son responsables de las propiedades básicas de una solución. Cuanto mayor es la concentración de OH⁻ en una sustancia, más básica será, y por lo tanto, su pOH será más bajo.
Relación entre pOH y pH
Existe una relación directa entre el pOH y el pH que permite entender de manera más completa el comportamiento ácido-base de una sustancia. Esta relación se expresa con la siguiente fórmula:pH + pOH = 14Esta fórmula es válida a una temperatura estándar de 25 °C. Gracias a esta relación, si se conoce uno de los valores (ya sea el pH o el pOH), es posible determinar el otro. Por ejemplo, si una solución tiene un pOH de 4, se puede calcular que su pH será 14 - 4 = 10. Esto indica que la solución es básica, ya que su pH es mayor que 7. Del mismo modo, si una sustancia tiene un pH de 3, su pOH será 11, lo cual muestra que es muy ácida.
Cómo calcular el pH






Aprende practicando

