Welcome
to Our Site

Químicos Curie



Fuerza de los ácidos y estructura molecular
¿Qué es un ácido desde el punto de vista estructural?

Desde el punto de vista molecular, un ácido es una sustancia cuya estructura contiene uno o más átomos de hidrógeno unidos a otros átomos más electronegativos, formando enlaces que pueden romperse para liberar protones (H⁺). Esta capacidad de ceder protones no depende solo de la presencia del hidrógeno, sino de cómo está unido, a qué átomo está enlazado, y cómo se comporta el resto de la molécula al perder ese protón. Por eso, la estructura molecular completa del ácido es clave para entender su comportamiento.
Relación entre estructura molecular y fuerza ácida
Polaridad del enlace O-H:Cuanto más polar sea el enlace entre el átomo de hidrógeno (H) y el átomo al que está unido (usualmente oxígeno, O), más fácil será la liberación del ion H⁺, resultando en un ácido más fuerte.

Estabilidad de la base conjugada:Un ácido es más fuerte si su base conjugada es más estable (menos reactiva). Factores que estabilicen la base conjugada (como la deslocalización de electrones o la presencia de grupos electronegativos) aumentan la fuerza ácida.

Efecto inductivo:Los átomos o grupos de átomos cercanos al enlace O-H pueden influir en la distribución de electrones, afectando la polaridad del enlace y, por lo tanto, la fuerza del ácido. Grupos electronegativos atraen electrones, debilitando el enlace O-H y aumentando la acidez.
Tamaño del átomo central:En los hidrácidos (ácidos con hidrógeno y un átomo central), a medida que aumenta el tamaño del átomo central (descendiendo en la tabla periódica), el enlace H-átomo central se debilita, aumentando la fuerza ácida.
Número de átomos de oxígeno:En los oxiácidos (ácidos con enlaces O-H), la presencia de átomos de oxígeno adicionales al átomo central aumenta la polaridad del enlace O-H, lo que incrementa la acidez.
Como ejemplo, consideremos esta relación en algunas series de ácidos



La energía del enlace H-X es determinante para justi-ficar la fuerza de los ácidos. Cuanto menor es dichaenergía, menos estable es el enlace y con mayor fa-cilidad se cede el ion H+ (tabla 1).

• Cuanto más electronegativo es el halógeno, más atraeal par electrónico que comparte con el oxígeno unidoal H. Al polarizarse más el enlace O-H, se ioniza el H conmás facilidad; en consecuencia, el ácido es más fuerte(tabla 2).


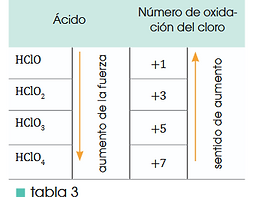

• Cuanto mayor es el número de átomos de O alrededordel Cl, mayor es la capacidad de este para polarizar elenlace O-H y con más facilidad se cede el ion H+; enconsecuencia, el ácido es más fuerte (tabla 3).
Ejemplo

