Welcome
to Our Site
Welcome visitors to your site with a short, engaging introduction. Double click to edit and add your own text.

Químicos Curie


Curvas de valoración
Una curva de valoración es un gráfico que se utiliza en química, sobre todo en análisis ácido-base, para visualizar cómo cambia el pH de una sustancia a medida que se le añade otra. Generalmente, se representa el pH en el eje Y (vertical) y el volumen del reactivo añadido en el eje X (horizontal).Se usa principalmente durante un proceso llamado valoración, que es una técnica de laboratorio en la que se añade lentamente una sustancia de concentración conocida (llamada titulante) a otra sustancia de concentración desconocida, hasta que reaccionan por completo.
Importancia de las curvas de valoración

Identificación del punto de equivalencia
Comprensión de reacciones ácido-base
Las curvas de valoración muestran claramente el punto de equivalencia, que es crucial para determinar la concentración de una sustancia desconocida.
Permiten visualizar cómo varía el pH durante la reacción, lo que ayuda a entender el comportamiento de ácidos y bases.
Aplicaciones en diversas áreas
Se utilizan en la industria farmacéutica (para determinar pureza de medicamentos), en química ambiental (para analizar la calidad del agua), y en química de alimentos (para controlar la acidez).
Optimización de experimentos
Al analizar la curva, se puede determinar la idoneidad ( adecuado ) de un indicador y las condiciones experimentales óptimas para una valoración.
Valoración de ácido fuerte con base fuerte
En una reacción entre un ácido fuerte y una base fuerte esperamos que el punto de equivalenciase encuentre alrededor de un pH de 7.
¿Qué estamos viendo?


¿Qué es el punto de equivalencia?
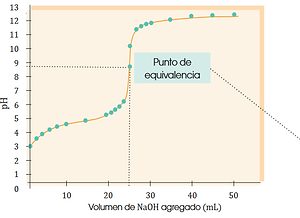
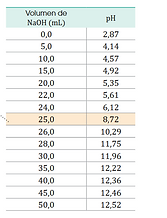
Es el momento justo en que la cantidad de ácido y base se neutralizan completamente. En este caso, ocurre cuando se han agregado 25 mL de NaOH, y el pH es 7.Esto tiene sentido porque es una reacción entre un ácido fuerte y una base fuerte: el pH del punto de equivalencia es neutro (alrededor de 7).
Esto es un ejemplo de valoración ácido-base, específicamente entre un ácido fuerte (como el HCl) y una base fuerte (como el NaOH).En esta práctica se va agregando poco a poco una base (NaOH) a un ácido, y se va midiendo el pH a medida que avanza la reacción.
¿Qué muestra la gráfica?
En el eje horizontal (x): el volumen de base (NaOH) que se ha agregado, en mililitros.En el eje vertical (y): el pH de la solución después de agregar esa cantidad de base.
Caso 2. Valoración de ácido fuerte con base débil
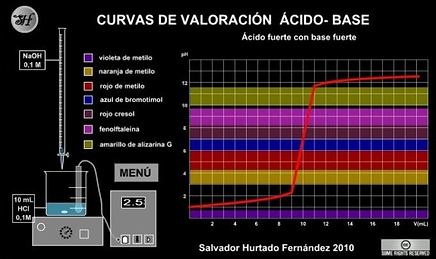
En la valoración entre un ácido fuerte con una base débil esperamos que el punto de equivalen-cia tenga un pH menor a 7.
Caso 3. Valoración de ácido débil con base fuerte
Al tener, en una reacción, una base fuerte con un ácido débil,se espera que el punto de equivalencia tenga un pH mayor a 7.