

A inicios de la década de los veinte, dos científicos (el danés Johannes Brønsted y el inglés Martin Lowry) de forma independiente, descubrieron y postularon una teoría ácido-base, que abarcaba más allá que la propuesta realizada por Arrhenius. Según esta teoría, un ácido es una sustancia química capaz de liberar iones hidrógeno, mientras que una base es aquella sustancia química capaz de aceptar iones hidrógeno. Esta teoría resultó útil para incluir a sustancias que con la teoría previamente existente no se habían incluido, como el amoniaco. Sin embargo, esta teoría seguía dejando afuera a varias sustancias con carácter ácido y que no poseían protones.
Según esta teoría:
Ácido : es una sustancia capaz de ceder un protón (a una base).
Base : es una sustancia capaz de aceptar un protón (de un ácido).
Las reacciones ácido-base son reacciones de transferencia de protones.


Johannes Nicolaus Brønsted (22 de febrero de 1879 – 17 de diciembre de 1947) fue un químico físico danés, conocido por desarrollar la teoría ácido-base de Brønsted-Lowry
Thomas Martin Lowry, nace el 26 de octubre de 1874 en Low Moor, Bradford, West Yorkshire. Estudió química con Henry Armstrong, un químico inglés interesado mayormente en la química orgánica, pero también en la ionización
Thomas Martin Lowry, muere el 2 de noviembre de 1936.



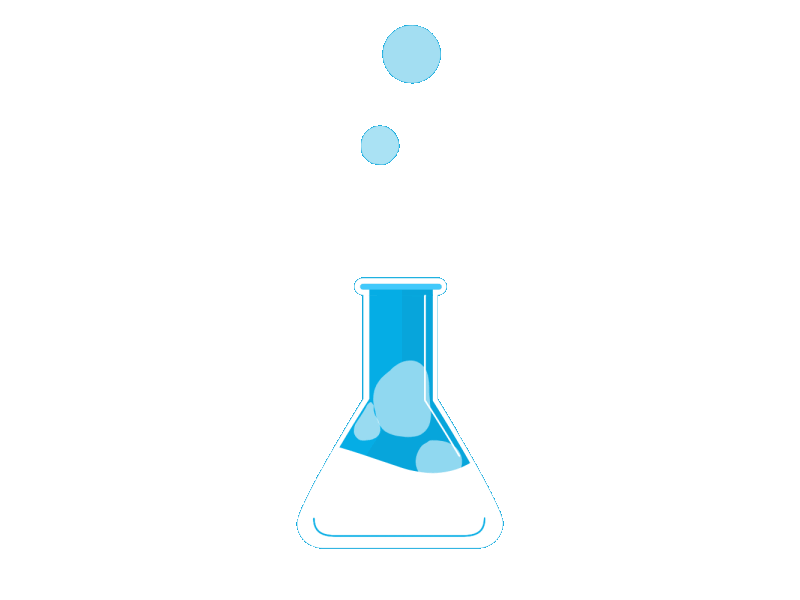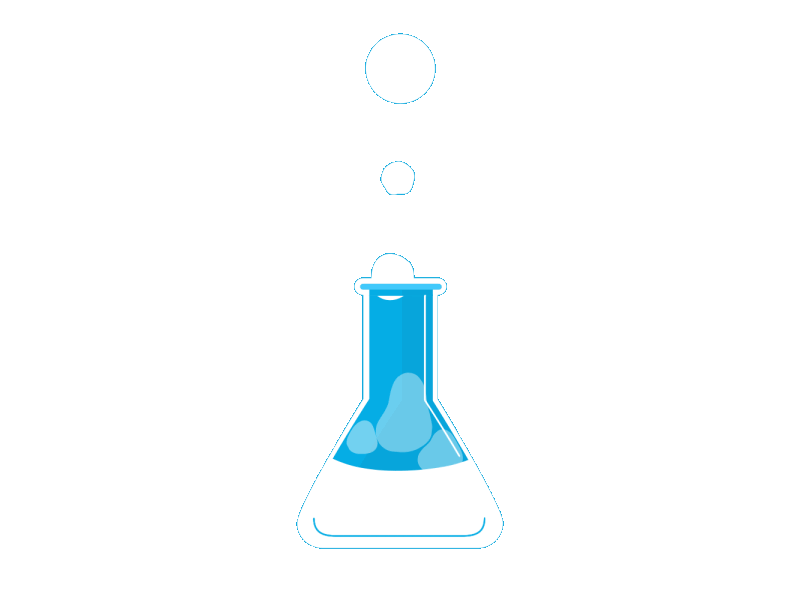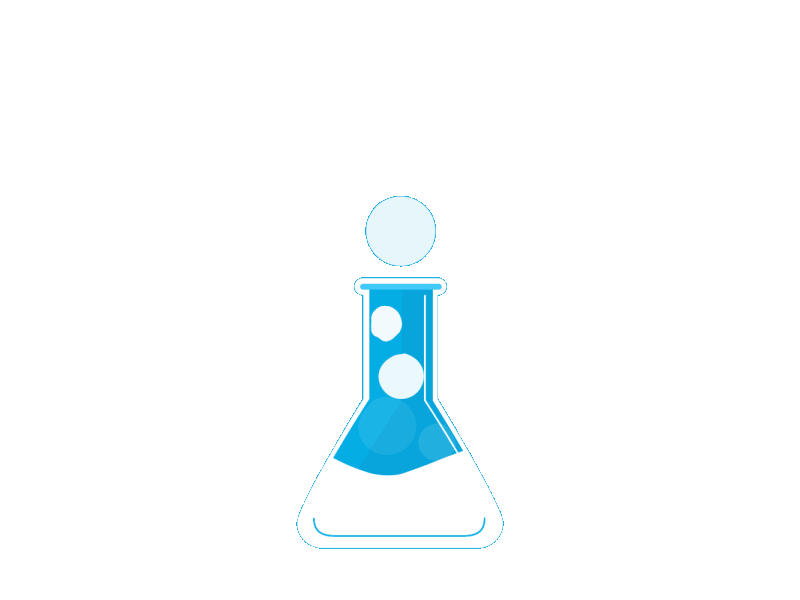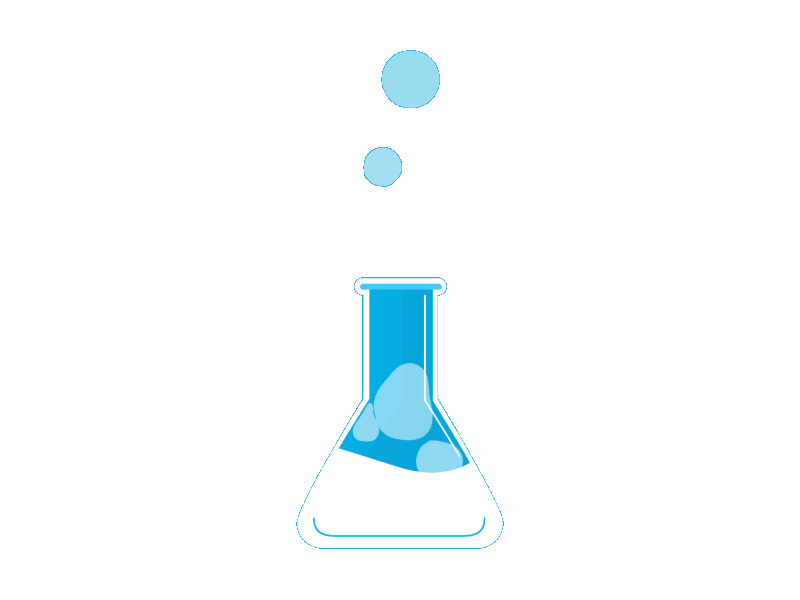
El ion oxonio o hidronio, H3O+
La reacción del ion H+ con unamolécula de agua se formula así:
H+ (aq) + H2O (l) → H3O+ (aq)
Sin embargo, parece que, enrealidad, se asocian al ion H+más de una molécula de H2O, yse forman especies como los iones H7O+3 y H9O+4, por asociaciónde tres y cuatro moléculas H2O,respectivamente




