Químicos Curie

Welcome
to Our Site
La Química es diversión



Fuerza de ácidos y bases

¿Qué es la fuerza de los ácidos y bases?
Cuando hablamos de la fuerza de un ácido o una base, no nos referimos a cuán corrosivo, peligroso o el fuerte de su sabor, sino a su capacidad para disociarse en agua y liberar sus iones. Es decir, un ácido fuerte es aquel que se separa completamente en iones cuando está en disolución acuosa, liberando todos sus protones (H⁺), mientras que una base fuerte libera completamente los iones hidroxilo (OH⁻).En contraste, los ácidos y bases débiles solo se disocian parcialmente. Esto significa que cuando los disolvemos en agua, solo una parte de sus moléculas se transforma en iones, y el resto permanece sin reaccionar. La fuerza de un ácido o base, entonces, depende del grado de disociación y no de la concentración. Un ácido puede estar muy diluido y seguir siendo fuerte si se disocia completamente.
La disociación ocurre debido a la interacción con las moléculas de agua. En el caso de los ácidos, estas donan protones (H⁺) al agua, formando iones hidronio (H₃O⁺). Por ejemplo, el ácido clorhídrico (HCl) al mezclarse con agua se convierte completamente en iones H₃O⁺ y Cl⁻. Como cada molécula de HCl se separa completamente, decimos que es un ácido fuerte.
El hidróxido de sodio (NaOH), una base fuerte, que en agua se disuelve totalmente liberando iones Na⁺ y OH⁻.
Un ácido como el vinagre (ácido acético) solo libera algunos iones H⁺ en el agua. La mayoría de sus moléculas permanecen unidas, por lo que se considera un ácido débil.
El amoníaco (NH₃) es un ejemplo de base débil, porque en agua solo una pequeña fracción de sus moléculas acepta protones y libera OH⁻.Lo que determina esta fuerza es principalmente la estabilidad del ion que se forma, la energía del enlace químico en la molécula original y la facilidad con que ese enlace se rompe. Cuanto más fácil se rompa el enlace y más estable sea el ion resultante, mayor será la disociación y, por tanto, mayor la fuerza.
Para entender mejor









Cuando usamos vinagre para limpiar o cocinar, no sentimos una quemadura en la piel porque es un ácido débil. Aunque tiene un sabor ácido, su capacidad para liberar protones es limitada. En cambio, una pequeña cantidad de ácido clorhídrico concentrado, usado en productos industriales para limpiar metales, puede causar graves quemaduras por ser un ácido fuerte.
Al preparar una torta o pan, usamos bicarbonato de sodio, que es una base débil. Al reaccionar con un ácido (como el limón o el vinagre), se produce dióxido de carbono que hace que la masa suba, pero la reacción es controlada y segura.
En nuestro cuerpo, el jugo gástrico contiene ácido clorhídrico (HCl), que es fuerte. Su alta capacidad de disociación permite que los alimentos se descompongan rápidamente durante la digestión. Sin embargo, si hay un exceso, puede provocar acidez, que muchas veces se alivia con antiácidos como el bicarbonato o la leche de magnesia, que son bases débiles.
La tendencia de los ácidos a ceder protones es muy variable.
El ácido clorhídrico, HCl, es un electrolito fuerte.
HCl (aq) + H2O (l) → H3O+ (aq) + Cl- (aq)
El ácido fluorhídrico es un ácido débil,con poca tendencia a ceder iones H+ a las bases. Como, asu vez, los iones F- formados por ionización tienden a reaccionar con los iones H3O+, se establece el equilibrio:
HF (aq) + H2O (l) → H3O+ (aq) + F- (aq)

La molécula de HCl está formada por H (hidrógeno) y Cl (cloro).
El HCl cede su protón (H⁺).
Ese H⁺ se une al agua (H₂O) y forma H₃O⁺ (ion hidronio).
El Cl⁻ queda como un ion libre en la solución.
La molécula de HF está formada por H (hidrógeno) y F (flúor).
Una parte del HF cede su protón H⁺.
Ese H⁺ se une al agua y forma H₃O⁺.
El flúor queda como F⁻.Pero como es débil, no todas las moléculas hacen eso.
Por eso, hay una reacción reversible: parte del H₃O⁺ y F⁻ se vuelven a juntar para formar HF.
• Los ácidos fuertes se ionizan completamente en las disoluciones acuosas diluidas, debido a su gran tendencia a ceder iones H+. Son ácidos fuertes:

HCl : Ácido clorhídrico
HClO₄ : Ácido perclórico
HBr : Ácido bromhídrico
HI : Ácido yodhídrico
H₂SO₄ : Ácido sulfúrico
HNO₃ : Ácido nítrico

Hay muy pocas bases débiles solubles en agua; entre ellas
NH₃ – Amoníaco

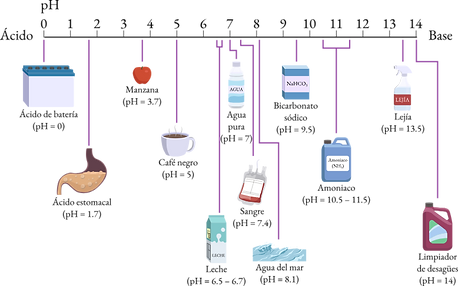
Ejemplo


Refuerza lo aprendido viendo este video


!Hora de practicar! Escanea este código y realiza el test basado en los temas vistos
